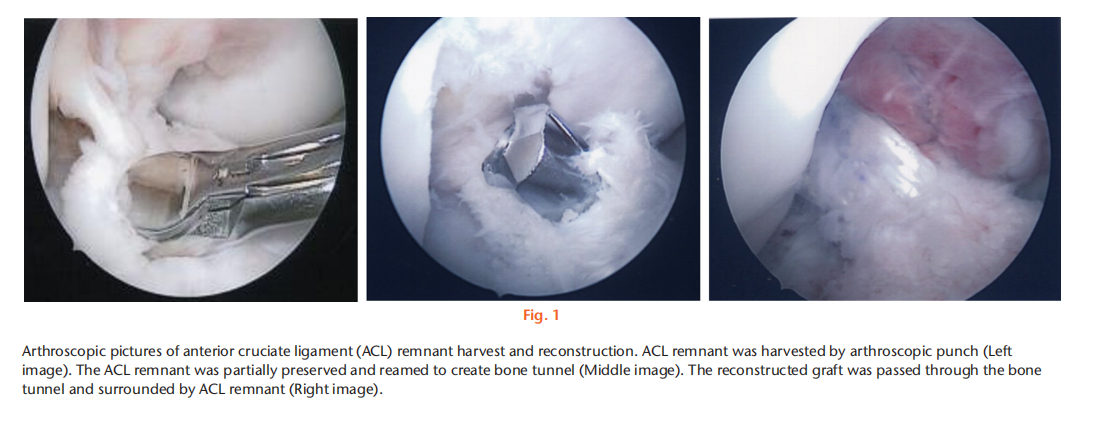
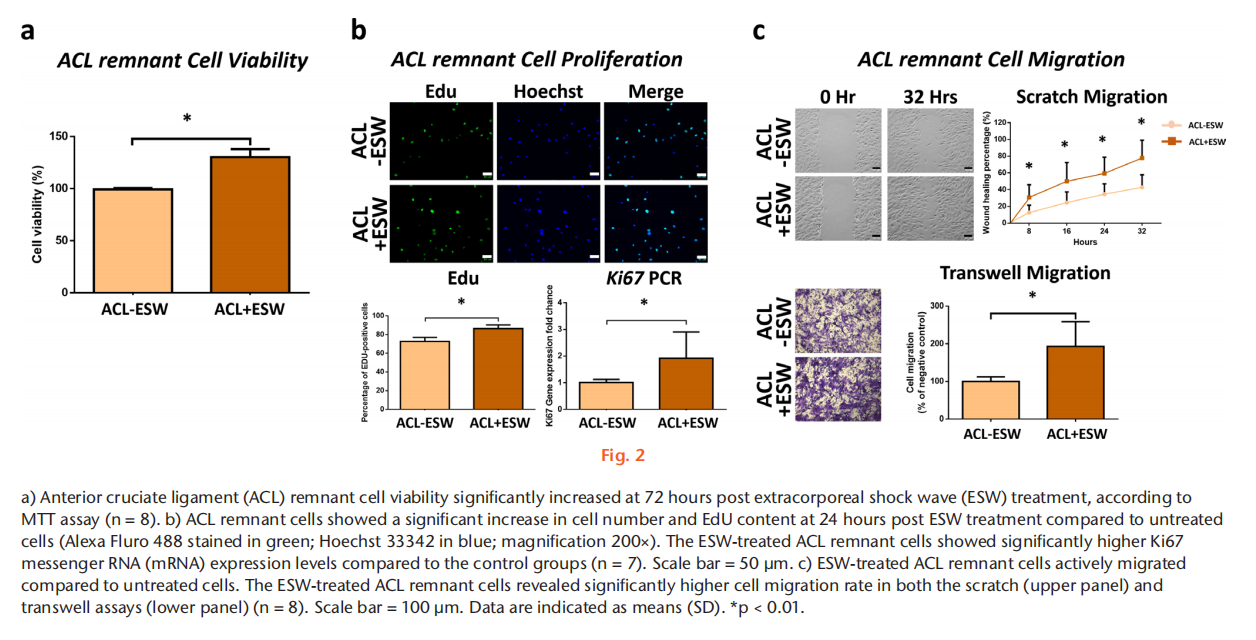
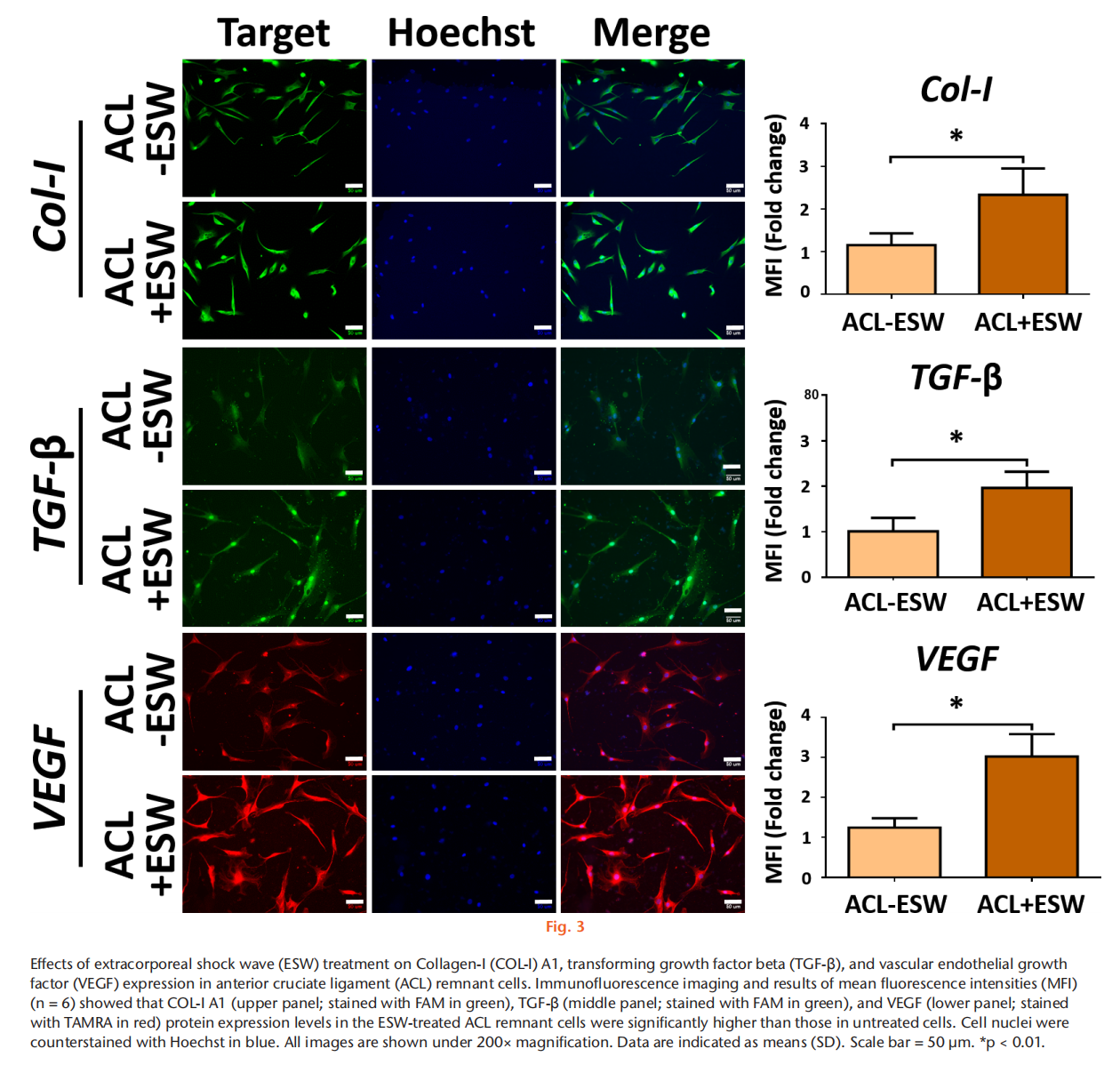
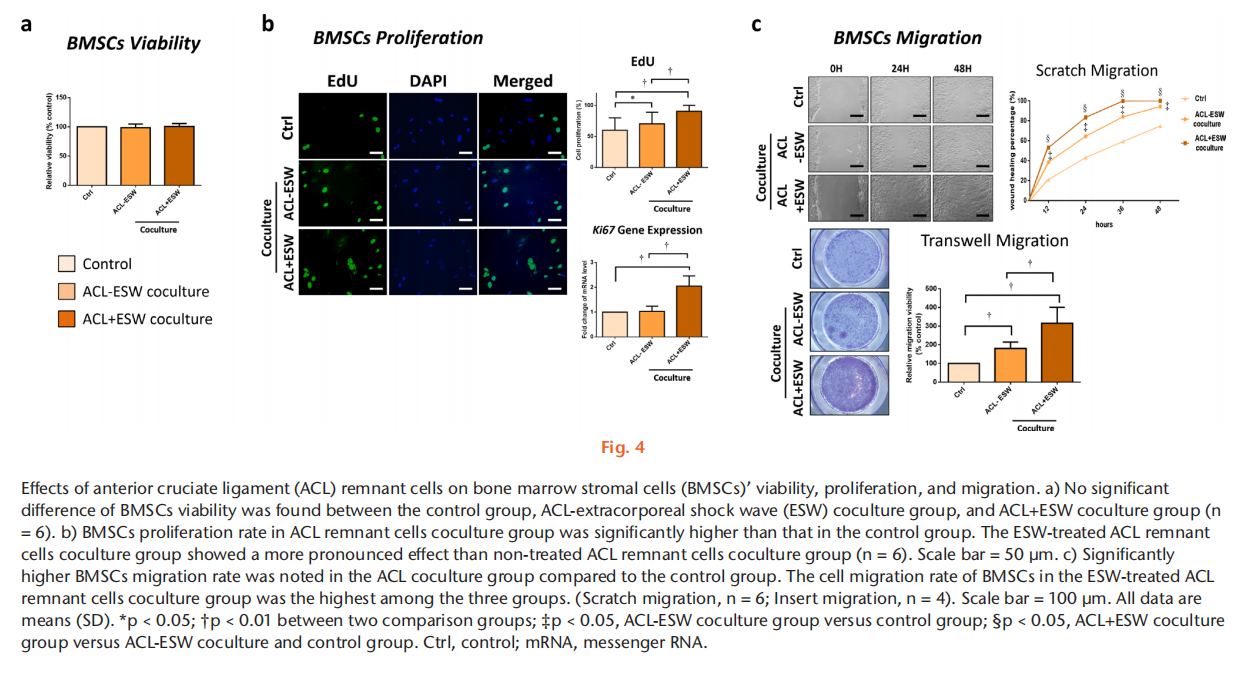
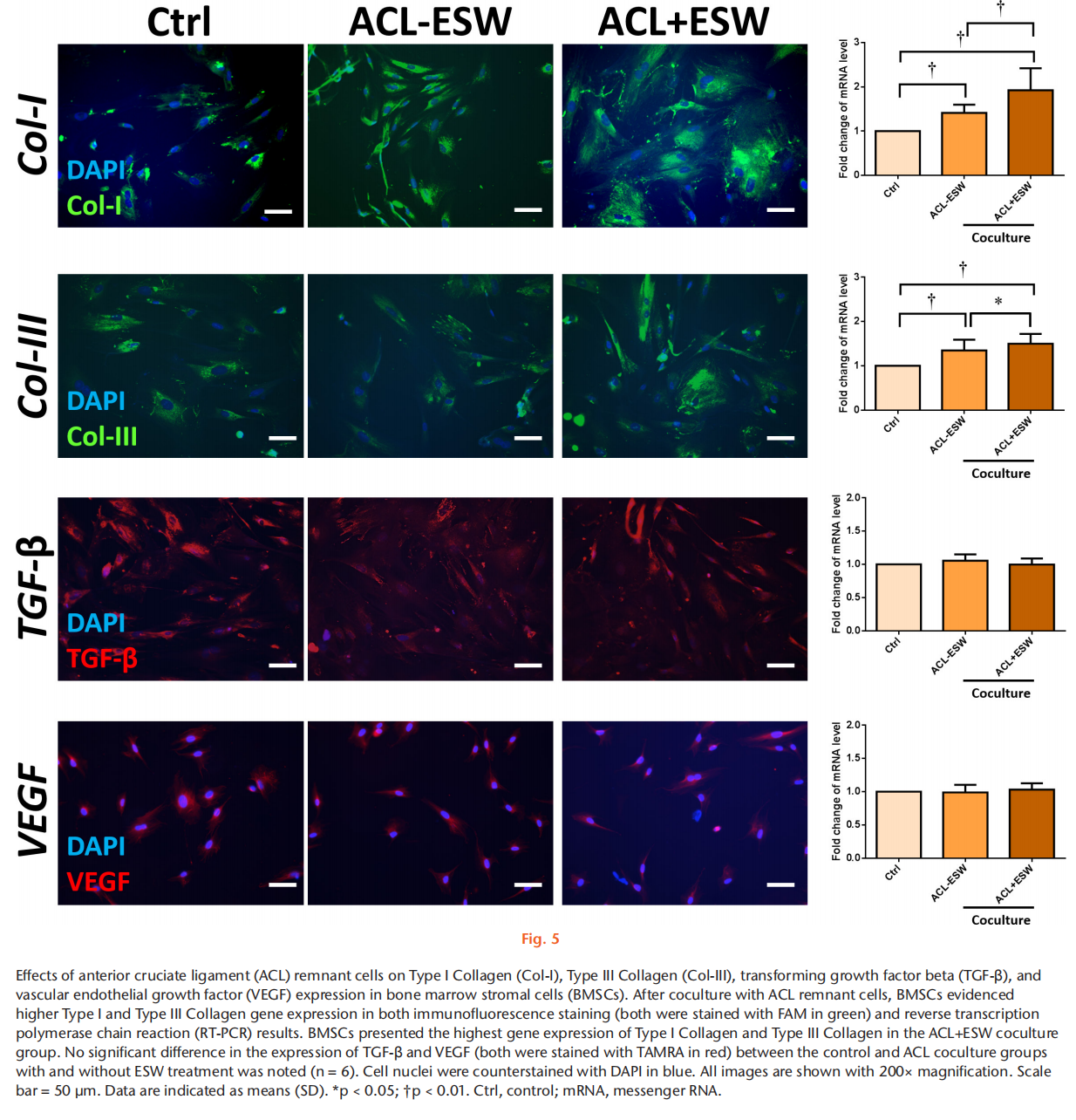
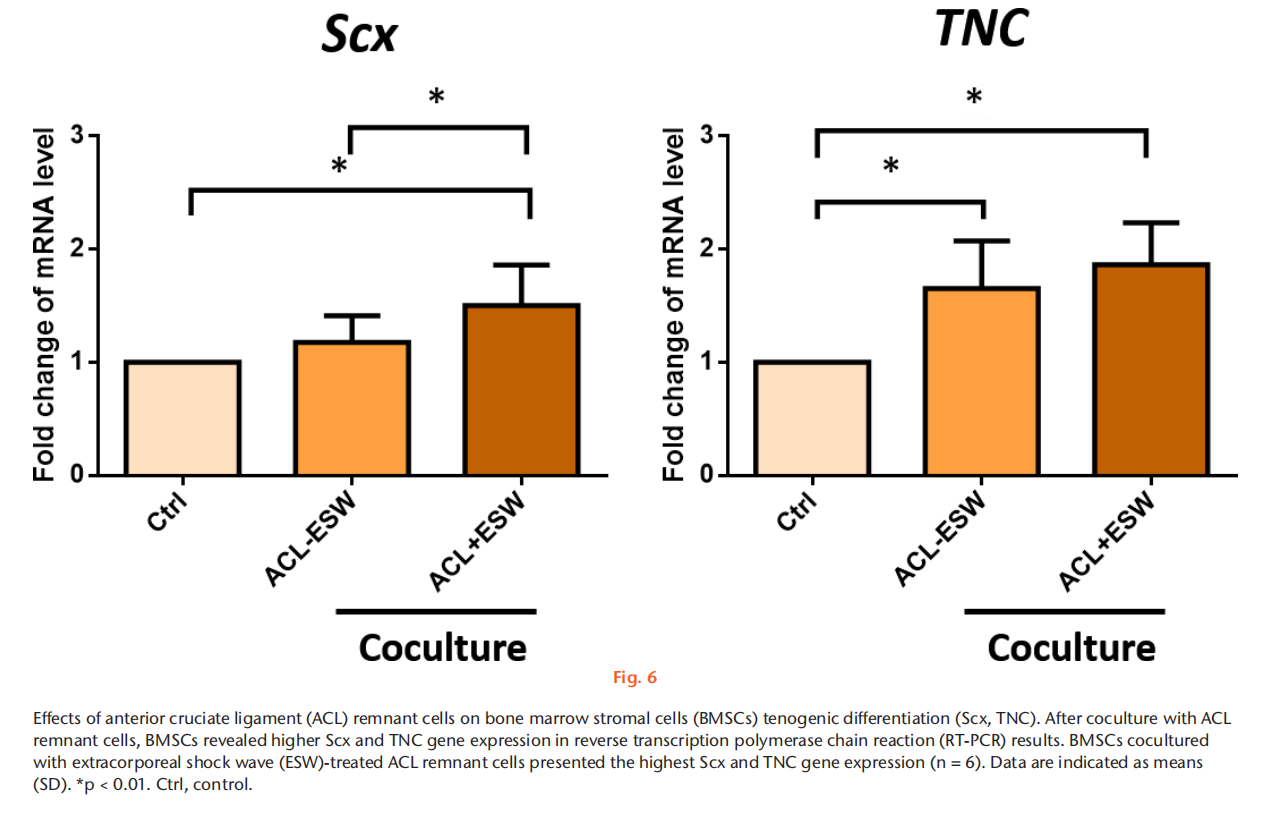
目的 方法 结果 结论 文章重点 ACL重建后,前交叉韧带(ACL)残留物与周围细胞之间的相互作用,以及体外冲击波(ESW)对ACL残留物细胞活性和周围细胞旁分泌调节的影响。 关键信息 - 在保留ACL残留物的ACL重建后,ACL残留物通过调节骨髓基质细胞(BMSCs)的增殖、迁移、胶原基因表达和肌腱分化潜力来帮助移植物成熟。 - ESW刺激了ACL残留物细胞的存活率、增殖、迁移以及胶原合成、转化生长因子β(TGF-β)和血管内皮生长因子(VEGF)的表达。 - 总体而言,ESW治疗不仅刺激了ACL残留物细胞的活性,还显著增强了其对周围细胞的调节能力,这将有助于移植物的成熟。 优势和局限性 - 第一项研究确认了ACL残留物与周围细胞之间的相互作用,以及ESW对ACL残留物细胞及其对周围细胞的调节能力的影响。 - 我们在体外研究了ESW对ACL残留物细胞的影响,但没有使用动物研究验证这些发现。 - 没有研究ESW治疗ACL残留物细胞和促进组织再生的最佳剂量和频率。 引言 膝关节损伤,尤其是涉及前交叉韧带(ACL)的损伤,在运动中很常见。由于ACL位于关节内,血液供应有限,并且存在细胞丢失,因此受伤的ACL愈合效果较差。在临床实践中,ACL重建手术可以恢复关节功能和运动能力。植入的移植物在ACL重建后的主要关注点是在移植-隧道界面的骨性整合和关节内移植物的重塑(韧带化)。植入后,移植物坏死导致生长因子和细胞因子的分泌,从移植物周缘(骨髓、滑膜和原有ACL的残余)向损伤部位引导细胞迁移。这些迁移的细胞进一步增殖并产生细胞外基质,并在生长因子的刺激下进行肌腱分化,促进韧带愈合。因此,了解ACL残余组织和细胞以及周围细胞在增殖、迁移、胶原合成、生长因子的分泌和分化方面的调节机制对于加速移植物早期愈合并预防ACL重建后的移植物断裂至关重要。 ACL重建中的残留物保护技术被提出来改善功能结果,通过增强细胞增殖、再血管化和本体感觉器官的再生来增加移植物的融合。然而,关于ACL重建中残留物保护的临床价值和结果仍存在争议。ACL残留物被证明含有干细胞,并且在体外研究中显示其增强了肌腱与骨隧道的愈合能力。在ACL重建过程中,ACL残余物环绕着植入的移植物,并与周围的组织和细胞接触(例如,来自钻孔骨隧道的骨髓基质细胞(BMSCs)覆盖着ACL残余物和植入的移植物;图1中间和右侧的图像)。然而,ACL残留物细胞在移植物再生中的实际作用以及它们与周围细胞的相互作用尚不清楚。 体外冲击波(ESW)是一种特点是短周期内快速压力上升和高峰压力的声波,已被应用于治疗多种骨科疾病。ESW治疗的可能机制包括机械力刺激、信号通路转导、生物分子分泌、离子通道改变以及细胞因子和生长因子的释放。ESW治疗促进软组织再生。研究表明,ESW治疗激活了不同细胞的增殖、迁移和基因表达。ESW已被提出作为ACL重建手术后促进移植物愈合的非侵入性治疗方法。Wang等人对ACL重建术后使用长指伸肌腱的兔子进行了500次14千伏的冲击波治疗,并证明在移植的肌腱与骨隧道接口处愈合显著改善。尽管这些结果令人鼓舞,但需要在体外阐明ESW对ACL残留物和周围细胞的生化过程的影响,以更好地指导随后的临床研究,评估ESW在ACL重建后改善移植物成熟的效果。 本研究假设ACL残留物细胞会调节周围细胞的行为,包括它们的增殖、迁移和胶原形成。我们还假设ESW治疗不仅会激活ACL残留物细胞,还会增强它们的旁分泌和下游调节BMSC活性和分化的能力。 方法 细胞分离:从接受ACL重建手术的8名患者(男性5名,女性3名;平均年龄23.5岁(标准差3.46);平均受伤时间3.3个月(标准差1.6))获取ACL残余组织。这些ACL残余组织在手术过程中通过关节镜切取(图1左图)。该研究程序已获得机构审查委员会的批准(KMUHIRB-F(I)-20160112)。去除外腱和周腱鞘后,将残余组织切成1mm至2mm厚的小块,并用磷酸盐缓冲液(PBS)洗涤。将组织以1000rpm,25°C的速度离心5分钟,收集后在低葡萄糖的Dulbecco修饰的鹰嘴豆培养基(Gibco DMEM;Thermo Fisher Scientific,Waltham,Massachussetts,USA)中培养,添加10%胎牛血清(Gibco FBS;Thermo Fisher Scientific)和1%抗生素(青霉素/链霉素;Gibco;Thermo Fisher Scientific),在37°C的5% CO2孵化箱中培养。在经过7到10天的时间内,从残余组织中迁移出的细胞经过无胶原酶消化的处理,称为P0代,并用0.25%胰蛋白酶(Gibco;Thermo Fisher Scientific)进行次级培养,直到达到80%的密度。本研究使用第三代ACL残留物细胞。 从骨髓中分离兔子的BMSCs,前期通过髂嵴抽取8ml骨髓液并培养。动物实验方案已获得机构动物护理和使用委员会(IACUC)的批准(KMU-105263)。本研究使用第三代BMSCs。 ESW治疗方案:使用电磁冲击波发生器以聚焦模式施加ESW治疗。密度为1×106个细胞/毫升的第三代残余细胞被放置在低温瓶中,并接受1000次冲击波刺激,刺激强度为0.15 mJ/mm2。对照组不接受ESW治疗。 ACL残留物细胞与BMSCs的共培养:为了研究ACL残留物细胞对其他细胞的调节能力,我们使用透明的系统(4μm孔径)将人类ACL残留物细胞与兔子BMSCs进行非接触式共培养。将1×105个BMSCs种植在含有MEM α(Gibco;Thermo Fisher Scientific)添加了10% FBS和1%抗生素(青霉素/链霉素)的培养板底部(下孔)上,在37°C和5% CO2条件下孵化。24小时后,废弃培养基,然后将未经ESW处理的ACL残留细胞(ACL-ESW共培养组)或经过ESW处理(1000次冲击波刺激,刺激强度0.15 mJ/mm2)的ACL残留细胞(ACL+ESW共培养组)种植在穿透式孔板(上孔)上,加入培养基(低葡萄糖DMEM,无血清,1%抗生素(青霉素/链霉素);全部来自Gibco;Thermo Fisher Scientific)。作为对照组,1×105个BMSCs在没有与ACL残留物细胞共培养的情况下进行单层培养。经过七天后,每组中的BMSCs以0.25%胰蛋白酶脱离并进行次级培养,以便进行其他实验。 细胞存活率。根据制造商的说明,通过MTT测定法确定ESW处理和未处理的ACL残余细胞以及共培养实验中所有的BMSCs(对照组、ACL-ESW共培养组和ACL+ESW共培养组)的细胞存活率。本研究使用ACL残余细胞和BMSCs的第三代细胞。这些细胞以5×103个细胞/孔的密度在含有200µl培养基(MEM α添加了10% FBS和1%青霉素/链霉素)的96孔板中培养,以37°C孵化48小时。使用Bio-Rad Microplate Manager Benchmark Plus Reader (Bio-Rad Laboratories, Hercules, California, USA)在570nm处测量吸光度。比较ESW处理和未处理的ACL残余细胞之间以及对照组、ACL-ESW共培养组和ACL+ESW共培养组之间的BMSCs的结果。 细胞增殖-EdU检测。根据制造商的说明,使用Click-iT EdU检测试剂盒(Thermo Fisher Scientific)分析细胞的增殖比率。在不同的共培养组中,ESW处理和未处理的ACL残余细胞以及BMSCs的第三代细胞在含有2ml培养基(MEM α添加了10% FBS和1%青霉素/链霉素)的12孔板中以2×104个细胞/孔的密度培养,以37°C孵化48小时。使用安装介质制备细胞载玻片,并用Hoechst 33342(Sigma-Aldrich,St. Louis,Missouri,USA)进行染色10分钟。使用荧光显微镜(Leica Microsystems CMS GmbH,Wetzlar,Germany)观察载玻片。细胞增殖率通过ImageJ(64位Java版本1.6.0_24;国家卫生研究院(NIH),Bethesda,Maryland,USA)计算,每个样品采用计算机化阶段设置随机抓取的五个区域进行分析,研究人员对研究组进行了盲目分析。 RNA提取和实时聚合酶链反应。在不同的共培养组中,ESW处理和未处理的ACL残余细胞以及BMSCs的第三代细胞在含有3ml培养基(MEM α添加了10% FBS和1%青霉素/链霉素)的6孔板中以2×105个细胞/孔的密度培养,以37°C孵化48小时。使用RNAzol试剂(MRC Inc,Cincinnati,Ohio,USA)提取总RNA。然后,使用Thermo Scientific Maxima First Strand cDNA Synthesis Kit(Thermo Fisher Scientific)按照制造商的说明,将纯化的总RNA逆转录为cDNA。 实时PCR使用SYBR Green PCR Master Mix(Thermo Fisher Scientific)在ABI 7900实时PCR仪器上进行。每个反应(20μl)均以三重复进行,并含有1μl的互补DNA(cDNA)模板和相应的引物(表I)。对于所有测试基因的阈值周期(Ct)进行了GAPDH的归一化(ΔCt)。将每个实验样品与其对照(ΔΔCt)进行比较。折叠变化值表示为2^-ΔΔCt。 划痕迁移实验。该实验旨在确定ESW处理和未处理的ACL残余细胞以及不同共培养组中BMSCs的迁移速率。来自每个组的第三代细胞以3 × 105个细胞/板的密度在6孔板中培养,并在37°C的5% CO2孵化箱中孵化。当细胞达到> 90%的密度时,使用无菌的200μl移液器尖端刮伤板。通过定期间隔(ESW处理和未处理的ACL残余细胞为8、16、24、32小时;不同共培养组中的BMSCs为12、24、36、48小时)观察实时细胞迁移状态,闭合划痕间隙。使用ImageJ计算细胞迁移速率的相对变化。 转移迁移实验。在一个孔径为8μm的6.5mm Transwell孔板(EMD Millipore, Billerica, Massachusetts, USA)中进行体外细胞迁移实验。在上腔室中接种ESW处理和未处理的ACL残余细胞以及不同共培养组中的BMSCs(每孔3×104个细胞),培养基中不含血清。在下腔室中加入含有10% FBS和1%青霉素/链霉素的MEM α作为趋化剂。在37°C孵化20小时后,迁移到下膜表面的细胞用4%福尔马林(PFA)固定10分钟,然后用0.5%结晶紫染色20分钟。在显微镜下计算每个孔中迁移的细胞数,并将其归一化到对照组的细胞数。相对细胞迁移能力通过迁移的处理细胞与对照组细胞的比率计算得到,并表示为迁移率(相对于对照组的百分比)。每个反应均进行了三次重复,并从这些结果中得出平均值。 免疫荧光染色。ACL残余细胞,包括ESW处理和未处理的细胞,以及不同共培养组中的BMSCs被接种在含有2ml培养基(MEM α添加了10% FBS和1%青霉素/链霉素)的16mm玻片上,每孔密度为2×104个细胞,并在37°C孵化48小时。然后,用4%福尔马林固定细胞15分钟和1%Triton-X-100处理1分钟,接着使用100µl阻断溶液(1% FBS在PBS中)预孵育20分钟。使用针对I型胶原(Sigma-Aldrich)、III型胶原(Arigo Biolaboratories)、转化生长因子β(TGF-β; Sigma-Aldrich)和VEGF蛋白(Arigo Biolaboratories)的初级抗体,在4°C过夜对细胞进行染色。然后,使用荧光二级抗体进行染色;山羊抗羊免疫球蛋白G(IgG)(H + L)-FAM(1:250; Leadgene Biomedical)用于ACL残余细胞中的I型胶原和TGF-β,以及BMSCs中的I型和III型胶原;山羊抗小鼠IgG(H + L)-TAMRA(1:250; Leadgene Biomedical)用于BMSCs中的TGF-β和ACL残余细胞以及BMSCs中的VEGF,持续一个小时,并用PBS洗涤三次。载玻片使用1μg/ml的Hoechst溶液(Sigma-Aldrich)对ACL残余细胞和BMSCs使用DAPI进行染色十分钟,然后用PBS洗涤三次,并在观察之前装载。使用ImageJ对六个样本中五个随机区域的荧光强度进行定量分析,这些区域通过计算机化阶段设置随机抓取,由对研究组进行盲目分析的科学家进行分析。与未经ESW处理的ACL残余细胞相比,ESW处理后ACL残余细胞的荧光强度结果显示为倍数变化。 统计分析。使用配对t检验分析ESW处理和未处理的ACL残余细胞之间的差异。在共培养实验中,使用单因素方差分析(ANOVA)和Tukey事后检验比较对照组、ACL-ESW共培养组和ACL+ESW共培养组之间的结果。所有数据均以平均值(标准差)表示。p < 0.05被视为具有统计学意义。所有统计分析使用SPSS软件版本20(IBM,纽约州阿蒙克)进行。 结果 ESW治疗增加了ACL残留细胞的存活能力、增殖能力和迁移能力。ACL残余细胞的存活能力在ESW治疗后的72小时内显著增加(图2a)。与未经处理的细胞相比,ESW治疗后ACL残余细胞的增殖率在EdU实验和Ki67基因表达中明显增加(图2b)。此外,ESW治疗后的ACL残余细胞比未经处理的细胞更积极地迁移入划痕区域(上面板)或下室(下面板)(图2c)。 ESW治疗上调了ACL残余细胞中COL-I A1、TGF-β和VEGF的表达。我们进行了免疫荧光染色以检测ESW治疗后COL-I A1、TGF-β和VEGF的表达。与未经处理的细胞相比,ESW治疗后ACL残余细胞中COL-I A1、TGF-β和VEGF蛋白水平显著上调(图3)。 BMSC(骨髓间充质干细胞)与带有和不带有ESW刺激的ACL残余细胞共培养后,其增殖和迁移速率增加。BMSC的细胞存活能力在对照组、ACL-ESW共培养组和ACL+ESW共培养组之间没有显著变化(图4a)。BMSC在与ACL残余细胞共培养后(无论是经过ESW处理还是未处理),根据EdU实验和Ki67基因表达水平,显示出较高的细胞增殖率(图4b)。划痕迁移实验显示,在与ACL残余细胞共培养12小时或更长时间后,BMSC的迁移率显著增加,并且ACL+ESW共培养组在所有时间点上的迁移率最高(图4c上面板)。这些结果与Transwell迁移研究结果一致(图4c下面板)。在增殖和迁移研究中,ESW处理后的ACL残余细胞对BMSC的活性影响更为显著,相比于未经ESW处理的ACL残余细胞。 ESW增强了ACL残余细胞上调BMSC胶原基因表达和肌腱分化的能力,但不影响TGF-β和VEGF的表达。与对照组相比,与ACL残余细胞共培养的BMSC显示出明显增加的I型和III型胶原水平(图5)和肌腱基因(Scx和TNC)表达(图6)。在三个组中,ACL+ESW共培养组的BMSC显示出最高的胶原和肌腱标记物基因表达。在对照组和ACL残余细胞共培养组之间,TGF-β和VEGF基因表达没有显著差异。 讨论 增强ACL残余和周围细胞的增殖、迁移和分化对于改善ACL重建后移植物成熟至关重要。本研究表明,ACL残余细胞通过旁分泌作用调节了BMSC的增殖、迁移、胶原合成和肌腱分化。与未经处理的细胞相比,ESW治疗激活了ACL残余细胞的细胞存活能力、增殖、迁移,并增加了COL-I A1、TGF-β和VEGF的表达,并且在ESW刺激后,它们对BMSC的旁分泌作用进一步增强,相比于未经ESW处理的ACL残余细胞。因此,ESW治疗可以通过激活残余细胞并增强其旁分泌作用来调节周围细胞的增殖、迁移、合成胶原和分化,从而改善ACL重建后的移植物成熟。 研究发现,ACL残余组织中含有间充质和血管干细胞,这些细胞在损伤修复中起重要作用。然而,另一项研究表明,存在ACL残余细胞时,结构较差,移植物愈合能力较低。同样,Lu等人指出,保留的肌腱残端保持了干性,增殖率较正常肌腱低。因此,仅通过未经刺激的ACL残余细胞改善移植物再生的能力是有限的。ESW通过不同的途径在不同的细胞中调节细胞增殖和迁移。震荡波通过PI3K/AKT途径促进神经干细胞的增殖,并通过激活mTORC1/FAK信号通路调节脂肪来源的间充质干细胞的增殖。ESW治疗还促进了来自断裂跟腱的人体腱细胞的增殖和迁移。在本研究中,ESW治疗增强了ACL残余细胞的增殖、迁移和胶原合成,促进了ACL重建后细胞迁移和增殖。然而,ESW如何增强ACL残余细胞的实际机制仍需进一步阐明。 生长因子的分泌和诱导是组织再生的重要过程,它们促进移植物的愈合。震荡波机械传导诱导了BMSC、间充质干细胞和韧带成纤维细胞中TGF-β的表达。在ACL重建过程中,TGF-β在TGF-β/MAPK信号通路中增强了肌腱-骨结合,减少了瘢痕组织进入隧道,促进胶原纤维形成,并增加了纤维细胞数量,对兔模型具有较好的预后。此外,TGF-β通过增强ACL成纤维细胞的增殖和基质合成介导了ACL重塑。一些研究报道,震荡波通过上调VEGF或其受体VEGFR2水平促进血管生成,并促进心脏、肌腱和肌腱-骨结合的再生。在免疫缺陷大鼠中,ACL残余来源的CD34+(内皮干细胞标记物)细胞通过激活血管生成和VEGF分泌来增强肌腱-骨愈合。在本研究中,我们观察到ACL残余细胞在ESW处理后分泌的TGF-β和VEGF水平升高。因此,基于ESW的机械传导可能激活ACL残余细胞释放TGF-β和VEGF,进一步增强ACL重建后移植物的再生能力。 在ACL重建中保留残余物的情况下,ACL残余物与周围组织和细胞之间的实际关系尚不清楚。本研究模拟了ACL重建过程中的情况,即植入的移植物穿过ACL残余物,并被来自钻孔骨隧道释放的BMSC覆盖。我们的研究结果显示,与ACL残余物细胞共培养可以增强BMSC的增殖、迁移、分化以及胶原合成和肌腱相关基因的表达。然而,我们观察到与ACL残余物细胞共培养后,BMSC的存活率和生长因子的分泌(TGF-β和VEGF)并未改变,这表明ACL残余物细胞保留了分泌旁分泌因子调节周围细胞活性和分化的能力,而不影响细胞的存活率和生长因子的分泌。这些结果提供了一个新的概念,即ACL残余物细胞可以调节周围细胞的活性和分化,增强ACL重建过程中的移植物愈合。ESW治疗已被证明可以刺激靶细胞的活性。然而,ESW处理的细胞与其他细胞的相互作用尚未得到很好的研究。本研究中,ESW治疗激活了ACL残余物细胞的存活率、迁移、胶原合成以及TGF-β和VEGF的表达。此外,与ESW处理的ACL残余物细胞共培养更深入地调节了BMSC的增殖、迁移、胶原表达和肌腱分化,相比于未经ESW处理的ACL残余物细胞共培养和对照组。结果表明,ESW可能不仅直接激活靶细胞,而且通过促进分泌调节周围细胞活性和分化的因子来激活周围细胞。然而,与ESW处理的ACL残余物细胞共培养后,BMSC的存活率和生长因子的分泌并未改善,因此与未经ESW处理的ACL残余物细胞共培养和对照组的结果没有显著差异。这些发现表明,ESW治疗可以增强靶细胞的固有能力,但无法创造新功能来调节周围细胞。 在临床实践中,ESW不仅会传递到ACL残余物,还会传递到重建区域的其他组织(例如肌腱移植物、骨髓、滑膜)。Vetrano等人的研究发现,ESW促进了ACL重建过程中取自半腱肌肌腱的肌腱细胞的增殖和胶原合成。Suhr等人的研究报道,ESW应用增加了人类BMSC的生长速率、增殖和迁移,并降低了凋亡率。他们的实验结果还显示,ESW可以诱导肌动蛋白骨架的重塑,并在ESW处理后保持BMSC的分化潜能。Wang等人首次研究了兔ACL重建模型中ESW的效果,他们的研究结果显示,ESW治疗显著增强了移植肌腱与骨隧道之间的界面愈合,从组织形态学和拉伸强度测试中得出。此外,Wang等人将ESW治疗(1,500脉冲,20千伏)应用于接受保留ACL残余物重建手术的患者的胫骨隧道中,即在同一麻醉期间立即进行治疗。两年后的随访中,接受ESW治疗的ACL重建患者的Lysholm评分显著改善,胫骨隧道扩大减少,与未接受ESW治疗的患者相比有所改善。本研究首次提出并证明了ESW可以增强ACL残余物细胞的活性和其对BMSC的调控作用,这可能有助于移植物的成熟。然而,需要进一步研究ACL残余物、肌腱细胞、BMSC和ESW刺激下的其他组织之间的相互作用,以澄清ESW对ACL重建中移植物成熟的影响。本研究存在一些局限性。首先,我们仅在体外研究了ESW对ACL残余物细胞的影响,但尚未通过动物实验验证这些发现。其次,我们承认间接共培养人类ACL残余物细胞和兔BMSCs,仅观察ACL残余物细胞对周围细胞的调控作用是有局限性的。为了了解ACL重建的临床情况,需要进行同一物种的ACL残余物细胞和周围细胞的直接接触共培养研究。第三,我们没有阐明ESW治疗对ACL残余组织的临床效果和精确机制。在临床应用ESW之前,需要确定其对治疗ACL残余物细胞和促进组织再生的最佳剂量和频率。几项研究报道了ESW对各种细胞活动和受损组织愈合的剂量依赖性影响。据我们所知,迄今为止还没有验证ACL残余物细胞的最佳ESW剂量的研究。未来的实验应该致力于在体外细胞研究和保留残余物的ACL重建动物模型中总结,我们的研究揭示了一些新的发现。我们证明了ACL残余物细胞通过增加周围细胞的增殖、迁移、胶原合成和分化来调节周围细胞的活动。ESW治疗不仅激活了ACL残余物细胞的活力、迁移、胶原合成和TGF-β、VEGF的分泌,还显著增强了其对周围细胞的旁分泌能力,从而增强了移植物的愈合。这些结果支持了在保留ACL残余物的ACL重建中应用ESW来增强移植物成熟的证据。 参考文献 略
前交叉韧带(ACL)残留物和周围细胞的增殖、迁移和分化是ACL重建的基本过程;然而,ACL残留物和周围细胞之间的相互作用尚不清楚。我们假设ACL残留物细胞保留了调节周围细胞活性、胶原基因表达和肌腱分化的能力。此外,体外冲击波(ESW)不仅可以促进ACL残留物细胞的活性,还可以增强它们对周围细胞的旁分泌调节。
比较了未经处理和经过ESW处理(0.15 mJ/mm2,1000次冲击,4 Hz)的ACL残留物细胞的细胞存活率、增殖、迁移和Collagen-I (COL-I) A1、转化生长因子β (TGF-β) 和血管内皮生长因子(VEGF)的表达水平。为了评估对周围细胞的后续影响,使用共培养系统研究了骨髓基质细胞(BMSCs)的存活率、增殖、迁移和I型胶原、III型胶原和肌腱基因(Scx、TNC)的表达水平。
经过ESW处理的ACL残留物细胞表现出更高的细胞存活率、增殖、迁移和COL-I A1、TGF-β和VEGF的表达增加。与单独培养的BMSCs组相比,与ACL残余细胞共培养后,BMSC的增殖和迁移率显著增加,无论是否经过ESW刺激。此外,ESW显著增强了ACL残留物细胞上调胶原基因表达和BMSCs的肌腱分化能力,而不影响细胞存活率、TGF-β和VEGF的表达。
ACL残留物细胞调节了周围细胞的活性和分化。结果表明,ESW增强了ACL残留物细胞的存活率、增殖、迁移和胶原、TGF-β、VEGF的表达,以及对BMSC增殖、迁移、胶原表达和肌腱分化的旁分泌调节能力。